- Mit molekularbiologischen Methoden können Ärzte und Forscher Eigenschaften von Tumoren untersuchen, sogenannte Tumormarker und andere Biomarker.
- Die Ergebnisse solcher Untersuchungen beeinflussen die individuelle Therapieplanung einer Patientin oder eines Patienten. Fachleute sprechen von personalisierter Krebsmedizin oder Präzisionsonkologie.
- Die folgenden Texte bieten einen Überblick über Biomarker in der Krebsmedizin: wie sie getestet werden, welchen Stellenwert sie haben und was Betroffene von einer Untersuchung erwarten können.
Hinweis: Informationen aus dem Internet können Ihnen einen Überblick bieten. Sie sind aber nicht dazu geeignet, die Beratung durch einen Arzt oder eine Ärztin zu ersetzen.
Mit Biomarkern Tumoren erkennen und charakterisieren
Zum Weiterlesen
Wer wissen möchte, was Erbinformationen, Gene, Proteine oder Mutationen sind und was sie mit Krebs zu tun haben, findet mehr dazu im Text Wie entsteht Krebs?
Krebszellen unterscheiden sich von den normalen Körperzellen eines Betroffenen. Beispielsweise stellen sie Eiweiße in anderen Mengen oder mit Baufehlern her. Dadurch ändern sich die Eigenschaften der betroffenen Zellen. Diese Unterschiede beruhen auf Veränderungen im Erbmaterial der Tumorzellen.
Die Veränderungen können von Patientin zu Patient unterschiedlich sein, selbst innerhalb einer Tumorart. Deshalb sind auch Tumore unterschiedlich: Beispielsweise kann der Darmtumor eines Patienten schneller wachsen als der einer anderen Patientin oder früher im Krankheitsverlauf Metastasen bilden.
Ärzte können solche Eigenschaften eines Tumors untersuchen, sie sprechen dabei von Biomarkern. Dazu nutzen sie häufig molekularbiologische Methoden.
Forscher untersuchen zunehmend die Einsatzmöglichkeiten von Biomarkern: in der Krebsfrüherkennung, in der Diagnostik und bei der Nachsorge von Krebspatienten. Teilweise haben Biomarker bereits einen belegten Nutzen, vor allem bei der Behandlungsplanung: Sie können zum Beispiel darauf hinweisen, wie aggressiv ein Tumor wächst und auf welche Therapie er ansprechen wird.
Personalisierte Krebsmedizin: Die passende Therapie finden
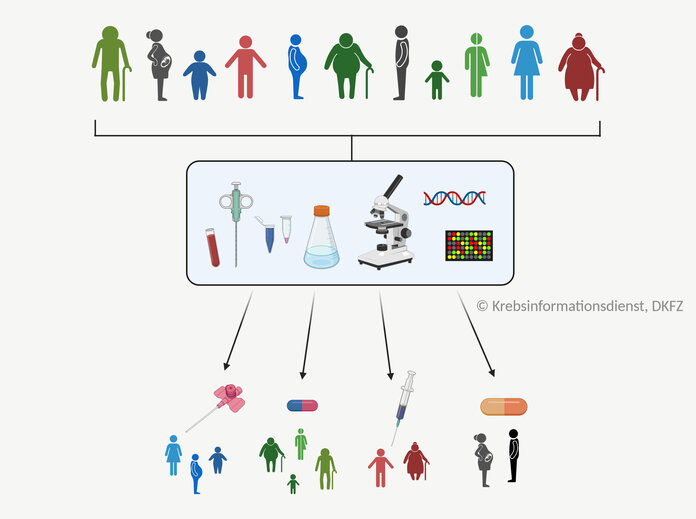
Bild: © Krebsinformationsdienst, DKFZ; erstellt mit BioRender.com
Für die Therapieplanung ist es wichtig, die individuelle Krebserkrankung eines Patienten zu untersuchen. Damit können Ärzte wichtige Fragen beantworten:
- Wie aggressiv wächst der Tumor eines Betroffenen voraussichtlich?
- Welche Therapie kommt infrage?
- Wie verträgt er oder sie eine bestimmte Behandlung? Welche Nebenwirkungen sind zu erwarten?
- Hat der Tumor auf die Behandlung angesprochen?
Ziel ist es, die Behandlung einer Patientin oder eines Patienten möglichst individuell auf die Erkrankung anzupassen. Fachleute sprechen auch von personalisierter Krebsmedizin oder Präzisionsonkologie.
Ein Beispiel sind zielgerichtete Krebstherapien: Sie hemmen nur Tumorzellen mit ganz bestimmten Eigenschaften. Damit sie wirken, ist es wichtig zu wissen, ob die Tumorzellen Betroffener den Marker für die jeweilige Eigenschaft tragen oder nicht.
Tumormarker, Biomarker, genetischer Marker: Was bedeutet das?
Es gibt unterschiedliche Marker, mit deren Hilfe Ärzte eine Krebserkrankung oder einen Rückfall erkennen und die Erkrankungssituation eines Betroffenen besser einschätzen können.
Biomarker ist in der Krebsmedizin der Überbegriff für alle messbaren Eigenschaften eines Tumors. Ihre Bestimmung liefert zusätzliche Informationen zur Krankheitssituation, zum wahrscheinlichen Krankheitsverlauf oder zur Wirksamkeit von Behandlungen.
Tumormarker sind eine Untergruppe der Biomarker. Es handelt sich um körpereigene Substanzen, die auf eine Krebserkrankung hinweisen. Sie werden von den Tumorzellen selbst oder von gesunden Körperzellen als Reaktion auf einen Tumor vermehrt gebildet. Bei den "klassischen" Tumormarkern handelt es sich in der Regel um Eiweiße oder eiweißhaltige Verbindungen. Sie sind im Blut, Urin oder anderen Körperflüssigkeiten nachweisbar.
Lexikon
Gen: Einzelner Abschnitt auf der Erbinformation (DNA) mit genetischer Information. Gene dienen der Zelle als Baupläne für Eiweiße.
Genetische Marker sind eine Untergruppe von Biomarkern. Ärzte und Forscher untersuchen dabei Veränderungen am Erbmaterial von Zellen.
- Untersuchen sie ein einzelnes Gen, sprechen Fachleute von einem Gentest.
- Auch Änderungen in der Ablesehäufigkeit von Genen dienen als Marker. Sie führen zu veränderten Eigenschaften der Krebszellen. Sie können mit sogenannten Genexpressionstests gemessen werden.
- Sind mehrere Gene in einem Test zusammengefasst, spricht man auch von einem Gen-Panel oder einem Multigentest.
- Erforscht wird auch, ob die Untersuchung des gesamten Erbmaterials eines Tumors Betroffenen einen Nutzen bringt, die sogenannte Tumorgenomsequenzierung.
Prognostischer Marker: Anhand von sogenannten Prognosemarkern können Ärzte den Krankheitsverlauf abschätzen. Sie können damit jedoch nicht für den einzelnen Patienten vorhersagen, wie die Erkrankung verläuft. Vielmehr handelt es sich um den statistisch wahrscheinlichen Verlauf, wie er an großen Patientengruppen beobachtet wurde.
Prädiktiver Marker: Mithilfe prädiktiver Marker untersuchen Ärzte am Tumormaterial, ob und wie eine bestimmte Behandlung bei einem einzelnen Patienten voraussichtlich wirken wird. Dabei kann es um Eigenschaften der Tumorzellen gehen, die sie empfindlich für eine Behandlung mit einem bestimmten Wirkstoff machen. Oder darum, wie der oder die Betroffene ein bestimmtes Medikament verstoffwechselt. Dadurch lassen sich zum Beispiel mögliche Nebenwirkungen einer Behandlung besser abschätzen. Nicht zu verwechseln sind diese Marker mit einem sogenannten prädiktiven Gentest, der vorhersagt, ob eine Person ein genetisch bedingt erhöhtes Krebsrisiko hat.
Wichtig zu wissen: Einige Marker lassen sich in mehrere dieser Gruppen einordnen: Ein genetischer Marker kann als prädiktiver Marker dienen, also vorhersagen, ob eine bestimmte Therapie wirkt. Ein Tumormarker kann als Prognosefaktor auf den Krankheitsverlauf hinweisen. Ein Prognosemarker, der auf einen aggressiveren Tumor hinweist, kann aber auch gleichzeitig ein gutes Ansprechen auf eine Behandlung gegen den Marker vorhersagen.
Quellen und Links für Interessierte und Fachkreise
Quellen zum Weiterlesen (Auswahl)
Im Folgenden finden Sie eine Auswahl an hilfreichen Links zum Weiterlesen und Quellen, die für die Erstellung dieses Textes genutzt wurden.
Leitlinien
In den Leitlinien zur Früherkennung, Diagnostik, Behandlung und Nachsorge der verschiedenen Krebsarten finden sich jeweils Angaben zum Stellenwert von molekularer Diagnostik und Biomarkern. Nach Leitlinien suchen können Sie bei der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF), beim Leitlinienprogramm Onkologie oder bei der Deutschen Gesellschaft für Hämatologie und Onkologie (DGHO).
Gesetze, Richtlinien und Stellungnahmen, aufgerufen am 1.12.2020
Im Gesetz über genetische Untersuchungen bei Menschen (Gendiagnostikgesetz - GenDG) ist festgelegt, wie eine genetische Beratung und Untersuchung durchgeführt wird.
Die Gendiagnostik-Kommission hat Richtlinien zur Umsetzung des Gendiagnostikgesetzes erstellt.
Der Deutsche Ethikrat hat eine Stellungnahme zur genetischen Diagnostik (PDF) verfasst.
Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen hat einen Rapid Report zu Biomarker-basierten Tests bei Brustkrebs erstellt.
Fachartikel
Cabel L, Proudhon C, Gortais H, Loirat D, Coussy F, Pierga JY, Bidard FC. Circulating tumor cells: clinical validity and utility. Int J Clin Oncol. 2017 Jun;22(3):421-430. doi: 10.1007/s10147-017-1105-2.
Cervena K, Vodicka P, Vymetalkova V. Diagnostic and prognostic impact of cell-free DNA in human cancers: Systematic review. Mutat Res . Jul-Sep 2019;781:100-129.
doi: 10.1016/j.mrrev.2019.05.002.
Chang L, Chang M, Chang HM, Chang F. Microsatellite Instability: A Predictive Biomarker for Cancer Immunotherapy. Appl Immunohistochem Mol Morphol. 2018 Feb;26(2):e15-e21. doi: 10.1097/PAI.0000000000000575.
Damodaran S, Berger MF, Roychowdhury S. Clinical tumor sequencing: opportunities and challenges for precision cancer medicine. Am Soc Clin Oncol Educ Book 2015. 35:e175-82. doi: 10.14694/EdBook_AM.2015.35.e175.
Faria SC, Sagebiel T, Patnana M, Cox V, Viswanathan C, Lall C, Qayyum A, Bhosale PR. Tumor markers: myths and facts unfolded. Abdom Radiol (NY). 2019 Apr;44(4):1575-1600. doi: 10.1007/s00261-018-1845-0.
Friedman AA, Letai A, Fisher DE, Flaherty KT. Precision medicine for cancer with next-generation functional diagnostics. Nat Rev Cancer. 2015 Dec;15(12):747-56. doi: 10.1038/nrc4015. Epub 2015 Nov 5.
Galarza Fortuna GM, Dvir K. Circulating tumor DNA: Where are we now? A mini review of the literature. World J Clin Oncol. 2020 Sep 24;11(9):723-731. doi: 10.5306/wjco.v11.i9.723.
Lianidou E, Pantel K. Liquid biopsies. Genes Chromosomes Cancer. 2019 Apr;58(4):219-232. doi: 10.1002/gcc.22695.
Pfarr N, Specht K, Weichert W. Bestimmung molekularer Biomarker in der Behandlung solider Tumoren: Methodik und Verlässlichkeit. Forum 2017;32:222–229. doi: 10.1007/s12312-017-0247-5
Poulet G, Massias J, Taly V. Liquid Biopsy: General Concepts. Acta Cytol. 2019;63(6):449-455. doi: 10.1159/000499337. Epub 2019 May 15.
Shaw KRM, Maitra A. The Status and Impact of Clinical Tumor Genome Sequencing. Annu Rev Genomics Hum Genet. 2019 Aug 31;20:413-432. doi: 10.1146/annurev-genom-083118-015034. Epub 2019 Apr 17.
Vaidyanathan R, Soon RH, Zhang P, Jiang K, Lim CT. Cancer diagnosis: from tumor to liquid biopsy and beyond. Lab Chip. 2018 Dec 18;19(1):11-34. doi: 10.1039/c8lc00684a.
Fachbuch
Thomas L. Labor und Diagnose. Frankfurt/Main: TH-Books; 2012, 8. Auflage.